破骨細胞足體環與研發骨質疏鬆症治療藥物

作者:劉英明(國立中興大學 生命科學系 教授兼系主任)
人體健康的骨質密度取決於成骨細胞(Osteoblasts, OBs)進行骨質生成與破骨細胞(Osteoclasts, OCs)進行之骨質再吸收的動態平衡(圖A)。過度活化破骨細胞也將增加蝕骨能力,終將導致骨質疏鬆症 (Osteoporosis)相關的骨骼病變。
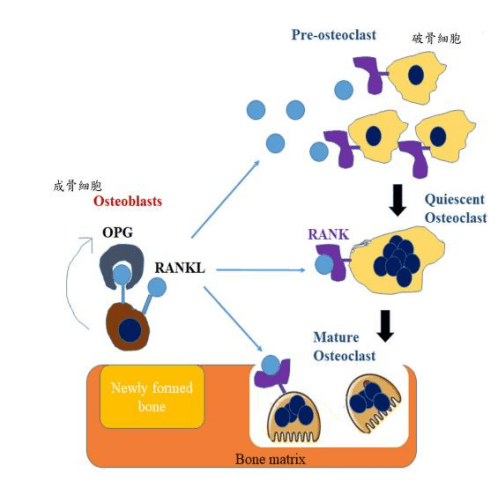
圖A:骨重塑是經由成骨細胞進行骨質生成與破骨細胞進行之骨質再吸收的動態平衡骨質密度的骨骼發育過程。
破骨細胞是由單核球/巨嗜細胞品系來源的造血幹細胞經由兩種主要細胞動力素-核因子 k-B 受體活化因子配體(Receptor activator of nuclear factor kappa-B ligand,RANKL)及巨噬細胞集落刺激因子(Macrophage colony-stimulating factor, M-CSF)刺激細胞分化、融合形成具有蝕骨功能的多核細胞 (Multi-nucleated cells)。
研究證據顯示:破骨細胞分化成熟會產生「肌動蛋白骨架為主結構與貼附膜上的訊息蛋白、蛋白激酶、鷹架蛋白等貼附組成的足體環(podosome)」(圖B);對於破骨細胞貼附、移動、重建胞外基質、與蝕骨等作用都扮演重要的角色 [1]。
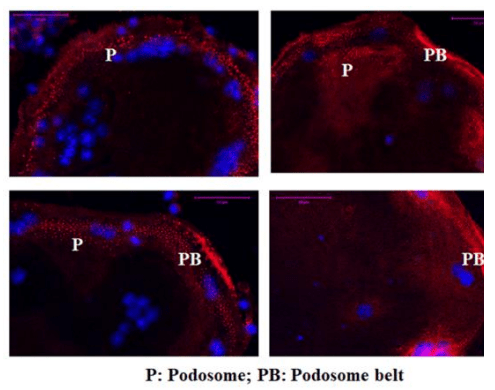
圖B:成熟多核破骨細胞會產生肌動蛋白骨架為主結構與貼附膜上的訊息蛋白、蛋白激酶、鷹架蛋白等貼附組成足體環。
破骨細胞的骨質再吸收功能也取決於足體環的結構,稱為密封區,會幫助破骨細胞緊密地黏在骨質上,而密封區內的細胞膜會形成褶皺帶,而破骨細胞的腹側與骨質會形成一個空腔,透過皺褶膜(或稱皺褶邊界)的 V型-ATP 酶將氫離子送入空腔裡面,從而降低環境的 pH 值,使其產生一個酸性的環境,提高降解骨基質蛋白酶的活性。
骨質疏鬆症是一種代謝性骨骼疾病,也是中高年齡族群最常見的骨折性疾病。根據統計,全世界患有骨質疏鬆性髖部骨折的患者人數超過2億。骨質疏鬆症的盛行率隨著人口老化逐日漸增,而台灣的老年人口自2013年底突破12%,人口老化的速度位居世界第二位,在2020及2030年分別將提升至16.1%和24.5%,預估在2025年將達到500萬人。
隨著人口高齡化和壽命延長,骨質疏鬆症正日益成為一種全球流行病。目前治療的主流藥物大部分是藉由抑制破骨細胞的蝕骨功能以利減緩骨質流失的問題,包括:雙磷酸鹽(bisphosphonates)、RANK 抑制劑、與選擇性雌激素接受器調節劑(selective estrogen receptor modulators, SERM)。
雙磷酸鹽(Zoledronic acid,Aclasta骨力強注射液),可經由與骨基質結合而抑制蝕骨細胞的活性,降低骨質流失。
RANKL 抑制劑(Denosumab,Prolia保骼麗),是一種單株抗體會與 RANKL 結合,減少破骨細胞成熟並促進其死亡,進而達到減少骨質流失的效果。
SERM(Raloxifene,Evista 鈣穩錠),可選擇性地作用在骨骼的雌激素接受器上,抑制破骨細胞,達到減少骨質流失。可是這些第一線的治療骨鬆藥物具有顯著抑制破骨細胞存活之功能,也因而會破壞骨質平衡,造成衍生的副作用。
為了不破壞破骨細胞與成骨細胞兩者間的動態平衡骨質密度;治療骨質疏鬆症藥物的研發策略可轉為減緩破骨細胞活性或蝕骨功能,而非直接殺死破骨細胞。
早期的研究發現,抑制鳥苷酸交換因子 GEF(Guanine nucleotide exchange factor)DOCK 5 會降低 Small GTPase(鳥糞嘌呤核苷三磷酸酶) Rac1 的活化,因此會影響破骨細胞形成足體環的細胞內組成結構,也會降低破骨細胞骨質再吸收的能力 [1]。
進一步的研究具有抑制 DOCK 5 的藥物-C21(DOCK5 抑制劑)以及對破骨細胞構造與功能的影響測試,也發現:C21 對破骨細胞內足體環的形成具有可逆性的影響;添加 C21 破壞破骨細胞內足體環的組成結構與蝕骨功能,移除 C21 後1小時,便又回復破骨細胞內足體環的組成結構與蝕骨功能 [2]。
相繼地實驗也證實:C21 在破骨細胞內,可影響骨架蛋白的分子整合形成足體環的結構與細胞蝕骨能力,但不會影響細胞的存活 [2]。在動物實驗,研究團隊也證實 C21 可以恢復骨鬆小鼠的骨質密度[2]。
另外,最近的研究論文也發現:細胞骨架(Cytoskeleton)調控蛋白- Caldesmon(CaD)可經由蛋白磷酸化與去磷酸化的可逆反應來調控破骨細胞內足體環的形成結構,也會影響破骨細胞融合效率與蝕骨能力 [3-4]。研究成果也提供設計「合成仿效胜肽(decoy phosphomimetic peptides)」來降低破骨細胞形成細胞內足體環與蝕骨能力。
未來透過進一步研究破骨細胞及破骨細胞生成的生物學特性,應可有效的開發新的治療藥物以對抗骨質疏鬆相關之骨骼疾病。
參考資料:
- Vives V, et al. The Rac1 exchange factor Dock5 is essential for bone resorption by osteoclasts. J Bone Miner Res. 2011; 26: 1099-110.
- Vives V, et al. Pharmacological inhibition of Dock5 prevents osteolysis by affecting osteoclast podosome organization while preserving bone formation. Nat Commun. 2015; 6: 6218.
- Liou YM, et al. Effect of l-caldesmon on osteoclastogenesis in RANKL-induced RAW264.7 cells. J Cell Physiol. 2018;233:6888-6901.
- Chan CL, et al. L-caldesmon alters cell spreading and adhesion force in RANKL-induced osteoclasts. J Biomed Sci. 2019;26:12.
瀏覽 1,750 次